[Die WMA Deklaration von Helsinki – Revision 2024: Eine Synopse und Perspektiven für Fachkräfte der Medizinischen Informatik, Biometrie und Epidemiologie]
Nils Freyer 1Myriam Lipprandt 1
Andreas Goldschmidt 2
Dominik Groß 3
Rainer Röhrig 1
1 Institut für Medizinische Informatik, Medizinische Fakultät, RWTH Aachen, Aachen, Deutschland
2 Institut für Arbeits-, Sozial- und Umweltmedizin, Goethe-Universität Frankfurt, Frankfurt, Deutschland
3 Institut für Geschichte, Theorie und Ethik der Medizin, Medizinische Fakultät, RWTH Aachen, Aachen, Deutschland
Zusammenfassung
Hintergrund: Sechzig Jahre nach ihrer Einführung im Jahr 1964 wurde die Deklaration von Helsinki (DvH) im Jahr 2024 erneut überarbeitet. In diesem Artikel geben wir einen kurzen geschichtlichen Überblick, gefolgt von einer Einführung in die Deklaration für die interdisziplinären und interprofessionellen Bereiche der Medizinischen Informatik, Biometrie und Epidemiologie.
Methoden: Eine kritische Synopse der Versionen 2013 und 2024 der DvH wurde vorgenommen und die Angemessenheit der Aktualisierungen für bestehende und neu entstehende Herausforderungen der medizinischen Forschung im Bereich der medizinischen Informatik, Biometrie und Epidemiologie diskutiert.
Ergebnisse: Die wichtigsten Neuerungen der neuen Fassung sind die Ausweitung des Adressatinnenkreises auf alle Forscher*innen, die an medizinischer Forschung mit menschlichen Teilnehmer*innen beteiligt sind. Außerdem werden terminologische Änderungen aus dem aktuellen Diskurs in der angewandten Ethik übernommen und die Forderungen nach Nachhaltigkeit und Gleichheit verstärkt. Die Verantwortlichkeit der Forscher*innen wird auf eine gesamtgesellschaftliche Verantwortung über die Studienpopulation hinaus erweitert. Grundsätze zur Anwendung der Künstlichen Intelligenz (KI) in der medizinischen Forschung sind nicht explizit enthalten, die Grundsätze der DvH lassen sich jedoch auch auf KI anwenden und adressieren viele KI-relevante Punkte.
Diskussion: Die Version 2024 der DvH weist im Vergleich zur Version 2013 deutliche Verbesserungen hinsichtlich der Rolle der Teilnehmer*innen, der Nachhaltigkeit und der Gerechtigkeit auf. Die Umsetzung des erweiterten Adressatenkreises stellt die Politik mit der Adaption im Berufsrecht und die Fachverbände und -gesellschaften vor neue Herausforderungen, ihre Verhaltenskodizes an die neue DvH anzupassen. Bedenken bezüglich KI in der medizinischen Forschung scheinen durch bestehende Artikel der DvH weitgehend adressiert zu werden. Explizite ethische Leitlinien für die Anwendung von KI in der medizinischen Forschung könnten allerdings nützlich sein, um für die Risiken und Möglichkeiten von KI konkrete Handlungsempfehlungen abzuleiten.
Schlüsselwörter
Ethikkodex, Ethik, Deklaration von Helsinki, Nürnberger Kodex, Ethikkommissionen
1 Einführung und historische Meilensteine
Interdisziplinarität und Internationalität sind heute mehr denn je zentrale Voraussetzungen für den Austausch über aktuelle Forschungsergebnisse und technische Entwicklungen im Gesundheitswesen. Die Deutsche Gesellschaft für Medizinische Informatik, Biometrie und Epidemiologie (GMDS), beispielsweise, ist traditionell seit Jahrzehnten an diesem kontinuierlichen Wissenstransfer zwischen ihren Fachgebieten beteiligt, die durch andere Disziplinen wie Medizinische Dokumentation, Bioinformatik und Public Health ergänzt wurden und werden [1]. Die Vielfalt interdisziplinär und interprofessionell zusammenarbeitender Disziplinen und Fachrichtungen stellt eine besondere Herausforderung dar, wenn es um die Beachtung ethischer Belange und Prinzipien geht, zumal diese einem ständigen Diskurs unterliegen und sich somit kontinuierlich verändern.
Die Deklaration von Helsinki (DvH) umfasst eine Reihe von ethischen Grundsätzen, die vom Weltärztebund (World Medical Association, WMA) als Leitlinien für die medizinische Forschung am Menschen entwickelt wurden. Sie gilt heute weithin als das grundlegende Dokument zur Ethik in der Forschung am Menschen [2].
Die ursprüngliche Fassung der DvH basierte auf den Grundsätzen des Nürnberger Kodex (1947) [3], [4], [5], [6]], der nach dem Zweiten Weltkrieg als erster allgemein anerkannter und akzeptierter ethischer Kodex für die medizinische Forschung am Menschen eingeführt wurde (vgl. Appendix B in Anhang 1 [Anh. 1]). Der Nürnberger Kodex war das Ergebnis des Nürnberger Ärzteprozesses 1946/1947, in dem Ärzte wegen „Kriegsverbrechen“ und „Verbrechen gegen die Menschlichkeit“ während der Diktatur der Nationalsozialisten angeklagt und in einigen Fällen auch verurteilt wurden [6], [7]. Der Zehn-Punkte-Kodex war Teil des Urteils und der Urteilsverkündung vom 19. August 1947. Der Kodex wurde zwar in Nürnberg zur Begründung der gefällten Urteile herangezogen, erlangte aber aufgrund seiner grundlegenden Bedeutung für die medizinische Forschungspraxis in der Folgezeit als eigenständiger Text weltweite Aufmerksamkeit und Anerkennung. Der Einfluss des Kodex zeigt sich nicht zuletzt darin, dass 1997, 50 Jahre nach der Urteilsverkündung im Ärzteprozess, ein „Nürnberger Kodex 1997“ veröffentlicht wurde. Er wurde von einer Gruppe von Ärzt*innen der IPPNW (International Physicians for the Prevention of Nuclear War) verfasst. Sie nahmen den Jahrestag zum Anlass, die Grundprinzipien des Kodex von 1947 in Erinnerung zu rufen und sie auf aktuelle medizinethische Fragen zu beziehen [8].
Der Nürnberger Kodex diente letztlich nicht nur als Bezugspunkt für die erste Fassung der DvH (1964), sondern auch für die Bioethik-Konvention des Europarates (1999), im Folgenden Oviedo-Konvention genannt, die ebenfalls im Zusammenhang mit der DvH diskutiert wird [9] (siehe Abbildung 1 [Abb. 1] und Tabelle 1 [Tab. 1]). Die Oviedo-Konvention war und ist – im Hinblick auf den Schutz der Menschenwürde und der Menschenrechte in Europa – lediglich als Mindeststandard zu verstehen [10] (siehe Tabelle 2 [Tab. 2]). Sie wird nicht von allen Mitgliedsstaaten als ausreichend angesehen. Nur 34 der 47 Mitgliedsstaaten des Europarates haben die Konvention bisher unterzeichnet, 26 weitere Staaten haben sie ratifiziert. Von den deutschsprachigen Ländern hat bisher nur die Schweiz den völkerrechtlichen Vertrag unterzeichnet und ratifiziert. Ein zentraler Kritikpunkt findet sich in Artikel 17 („Schutz einwilligungsunfähiger Personen bei Forschungsvorhaben“ (Übers. d. Verf.)): Dieser Artikel eröffnet die Möglichkeit der Forschung an einwilligungsunfähigen Personen – ein besonders umstrittener Aspekt der biomedizinischen Forschung [9].
Abbildung 1: Venn-Diagramm zur Visualisierung der Überschneidungen zwischen der Oviedo-Konvention, dem Nürnberger Kodex und der Deklaration von Helsinki; schematisch, nicht quantitativ (vgl. Tabelle 2). Der Nürnberger Kodex diente letztlich nicht nur als Bezugspunkt für die erste Fassung der DvH (1964), sondern auch für die Oviedo-Konvention (1999), die ebenfalls im Zusammenhang mit der DvH diskutiert wird [9]. Die Deklaration von Helsinki in der Fassung von 2024 stellt eine wesentliche Weiterentwicklung der ethischen Standards für die medizinische Forschung dar. Sie erweitert den Umfang der Verantwortung, stärkt die Rechte und den Schutz der Teilnehmenden und integriert gegenwärtige ethische Überlegungen zur Nachhaltigkeit und wissenschaftlichen Integrität. Mit diesen Änderungen soll sichergestellt werden, dass die medizinische Forschung ethisch vertretbar, teilnehmerorientiert und zum Nutzen der Gesellschaft ist und gleichzeitig strenge wissenschaftliche Standards eingehalten werden.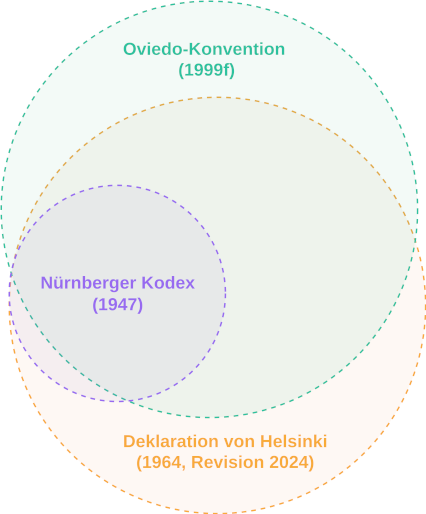
Tabelle 1: Als einziges internationales rechtsverbindliches Instrument zum Schutz der Menschenrechte im biomedizinischen Bereich legt die Oviedo-Konvention [10] grundlegende Prinzipien zum Schutz der Menschenwürde in den sich rasch entwickelnden Bereichen der Biologie und Medizin fest. Mit diesen Grundsätzen soll die Oviedo-Konvention sicherstellen, dass die Entwicklungen in der Biomedizin künftigen Generationen und der gesamten Menschheit zugutekommen und gleichzeitig die grundlegenden Menschenrechte und die Menschenwürde in diesem sich schnell entwickelnden Bereich geschützt werden.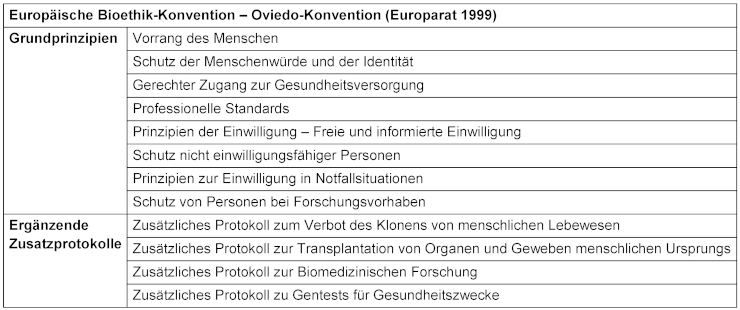
Tabelle 2: Überschneidungen und Unterschiede einiger Prinzipien (siehe Abbildung 1: Venn-Diagramm) von Deklaration von Helsinki (DvH 2024), Oviedo (1999) und Nürnberger Kodex (1947). Allen drei Deklarationen gemeinsam sind die Prinzipien der freiwilligen, informierten Einwilligung, des Vorrangs des Einzelnen, des Schutzes der Würde und der Rechte, der Qualifikation der Forscher*innen und des Rechts, von der Teilnahme zurückzutreten. Nürnberg und Helsinki konzentrieren sich auf den sozialen Nutzen. Die Oviedo-Konvention und die Deklaration von Helsinki betreffen insbesondere den Umgang mit Vulnerabilität, eine gerechte Gesundheitsversorgung und die Rolle der Ethikkommissionen.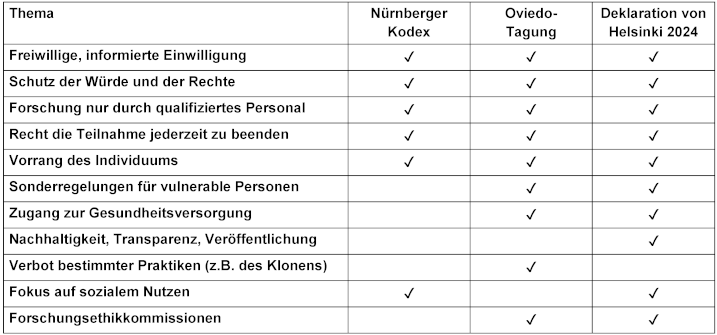
Anders als der Nürnberger Kodex, der in erster Linie zum Zwecke der Rechtsprechung formuliert wurde, und die besagte Initiative des Europarats war die DvH die erste ausdrückliche Initiative der medizinischen Gemeinschaft zur Standardisierung ethischer Forschungspraktiken. Die erste Fassung der Deklaration wurde 1964 in Helsinki, Finnland, verabschiedet. Damals stieß sie jedoch auf ein gemischtes Echo, da sie noch deutlich paternalistische Züge aufwies. Zwar wurde zwischen therapeutischen Experimenten und klinischer Forschung unterschieden, doch wurde das Recht auf medizinische Behandlungsfreiheit bekräftigt: Die informierte Einwilligung der Patient*innen sollte nur eingeholt werden, wenn dies möglich und aus medizinischer Sicht „vernünftig“ war [9]. Seitdem wurde die DvH mehrfach überarbeitet und präzisiert, um den sich ändernden Rahmenbedingungen der Medizinethik und Forschungspraxis, aber auch den kulturellen und sozialen Veränderungen im Verhältnis zwischen Patient*innen und Ärzt*innen (Etablierung der Patientenautonomie als zentrales ethisches Prinzip) Rechnung zu tragen. Während sie sich anfangs vor allem in Bezug auf die informierte Einwilligung vom Nürnberger Kodex unterschied, indem sie von „unbedingt notwendig“ zu „wenn möglich“ überging und Bevollmächtigte zuließ [11], hat sich die Deklaration in den letzten Jahrzehnten von 11 auf 37 Artikel erheblich weiterentwickelt und damit eine Reihe von Änderungen erfahren.
Sechzig Jahre nach ihrer ursprünglichen Einführung wurde die DvH im Jahr 2024 zum achten. Mal überarbeitet (bis heute gab es acht Überarbeitungen und zwei Klarstellungen, so dass die DvH von 2024 die elfte Version ist) [12]. Während Organisationen, die in der Humanforschung tätig sind, die DvH bereits auch für nicht-medizinisches Fachpersonal übernehmen – die GMDS verlangt von all ihren Mitgliedern, die Deklaration in ihren ethischen Richtlinien zu kennen und danach zu handeln [13] – ist es das erste Mal, dass sich die WMA mit der DvH ausdrücklich an Forscher*innen wendet, die kein medizinisches Fachpersonal sind. Neben dieser historischen Einordnung zielt dieser Artikel daher darauf ab, die DvH einzuführen und kritisch zu diskutieren, wobei der Schwerpunkt auf der medizinischen Informatik, Biometrie und Epidemiologie liegt.
Darüber hinaus sollen die Unterschiede zwischen den DvH-Revisionen von 2013 (Fortaleza) und 2024 (Helsinki) aufgezeigt werden. Es ist von besonderem Interesse, die Änderungen im Hinblick auf ihre Relevanz für die medizinische Datenwissenschaft zu identifizieren und zu diskutieren. Eine systematische Synopse der DvH in den Fassungen 2023 und 2024 findet sich in Appendix A in Anhang 1 [Anh. 1].
2 Die Deklaration von Helsinki im Jahr 2013 und 2024: Inhalt und Aktualisierungen
Die DvH-Revision 2024 gliedert sich in eine Präambel und einen Abschnitt mit allgemeinen Grundsätzen, die durch 10 Unterabschnitte weiter unterteilt sind. Der WMA weist darauf hin, dass die Deklaration als Ganzes gelesen werden sollte; die vollständige Deklaration ist auf der Website des WMA [12] zu finden. Im Folgenden wird eine kurze Einführung in den Inhalt der Deklaration gegeben, um einen Überblick über die von der DvH behandelten Themen zu geben und die Aktualisierungen, über die wir berichten und diskutieren werden, besser zu kontextualisieren.
2.1 Allgemeine Prinzipien der DvH
Die DvH stellt das Wohlergehen des Einzelnen über die Interessen von Wissenschaft und Gesellschaft (Art. 7) und plädiert für die Minimierung von Risiken und Belastungen sowie für den Nachweis, dass die damit verbundenen Risiken und Belastungen durch den vermeintlichen Nutzen der durchgeführten Forschung gerechtfertigt sind (Art. 16–18). Sie unterstreicht die Notwendigkeit, Forschung auf der Grundlage wissenschaftlich fundierter Protokolle durchzuführen (Artikel 22), die von unabhängigen Forschungsethikkommissionen (FEKs) überprüft und genehmigt werden müssen, um den Schutz der Teilnehmer*innen zu gewährleisten (Artikel 23). In Artikel 23 heißt es weiter, dass die Ethikkommissionen „die ethischen, rechtlichen und behördlichen Normen und Standards des Landes bzw. der Länder, in dem/denen die Forschung durchgeführt werden soll, sowie die anwendbaren internationalen Normen und Standards berücksichtigen“ (Übers. d. Verf.) müssen, wobei jedoch betont wird, dass diese den in der DvH festgelegten Schutz der Patient*innen nicht außer Kraft setzen dürfen. Ein wichtiger Grundsatz der DvH ist das Erfordernis der Einwilligung nach Aufklärung, wonach die Teilnehmer*innen oder ihre Bevollmächtigten vollständig über den Zweck der Studie, die Verfahren, die potenziellen Risiken, den Nutzen und die Belastungen informiert sein müssen, bevor sie einer Teilnahme zustimmen (Art. 25–32). Zusätzlich unterstreicht sie die Bedeutung der Wahrung der Privatsphäre der Teilnehmer*innen und der Vertraulichkeit (Artikel 24) und geht auf die besonderen Bedürfnisse und Schutzmaßnahmen ein, die für Einzelpersonen, Gruppen und Gemeinschaften in Situationen der Vulnerabilität erforderlich sind, während sie sich allgemein für deren Einbeziehung in die medizinische Forschung einsetzt (Artikel 19–20).
Über den Schutz der Teilnehmer*innen hinaus betont die DvH Aspekte der wissenschaftlichen Integrität, der globalen Gerechtigkeit und der ökologischen Nachhaltigkeit. Sie plädiert für die Verantwortung von „Forscher*innen, Autor*innen, Sponsoren, Herausgeber*innen und Verleger*innen“ (Übers. d. Verf.), Transparenz und Integrität bei ihrer Arbeit zu gewährleisten (Art. 35–36). Dies schließt die Verpflichtung ein, alle Forschungsergebnisse, ob positiv oder negativ, zu veröffentlichen, um zum kollektiven wissenschaftlichen Wissen beizutragen und Doppelarbeit zu vermeiden (Art. 36). Die Deklaration erkennt ferner an, dass die medizinische Forschung von Natur aus in Strukturen sozialer Ungleichheit eingebettet ist, und fordert eine Verteilung des Nutzens, der Risiken und der Lasten, die sich aus der Durchführung und den Ergebnissen der medizinischen Forschung ergeben (Art. 6). Sie adressiert die Notwendigkeit einer ständigen ethischen Reflexion, die Anpassung an neue wissenschaftliche Fortschritte, sowie die Anwendbarkeit der Deklaration in unterschiedlichen kulturellen und sozialen Kontexten.
2.2 Qualitative Analyse der Veränderungen
In der Version 2024 der DvH wurde die Terminologie deutlich überarbeitet. Die Analyse der terminologischen Änderungen bezieht sich auf die englischen Originalfassungen der DvH von 2013 und 2024. Die Terminologie wurde im Original von „subjects“ (z. Dt.: Subjekte) auf „participants“ (z. Dt.: Teilnehmer*innen) umgestellt, was einen stärker teilnehmerzentrierten Ansatz widerspiegelt, der die Freiwilligkeit und die Achtung der Autonomie betont. In der deutschen Übersetzung der Version von 2013 wurde „human subjects“ allerdings bereits stellenweise als „Teilnehmer“, stellenweise auch als „Menschen“ übersetzt. Darüber hinaus werden in der Fassung von 2024 die ethischen Verpflichtungen nicht nur auf Ärzt*innen, sondern auf alle an der medizinischen Forschung beteiligten Forscher*innen ausgedehnt, was auf eine breitere Anwendung der ethischen Standards hinweist. Schließlich werden in der neuen Fassung bestimmte ethische Erwägungen stärker betont, insbesondere in Bezug auf die Autonomie, die Privatsphäre und die Rechte der Teilnehmer*innen sowie Überlegungen zu strukturellen Ungleichheiten. Dazu gehört auch eine ausdrücklichere Erwähnung der wissenschaftlichen Integrität und der Notwendigkeit, Fehlverhalten in der Forschung zu vermeiden. Die wichtigsten Änderungen sind in Tabelle 3 [Tab. 3] zusammengefasst.
Tabelle 3 : Die wichtigsten Änderungen, die bei der qualitativen Analyse der Synopse der DvH 2013 und 2024 festgestellt wurden. Die vollständige Synopse ist in Appendix A in Anhang 1 zu finden.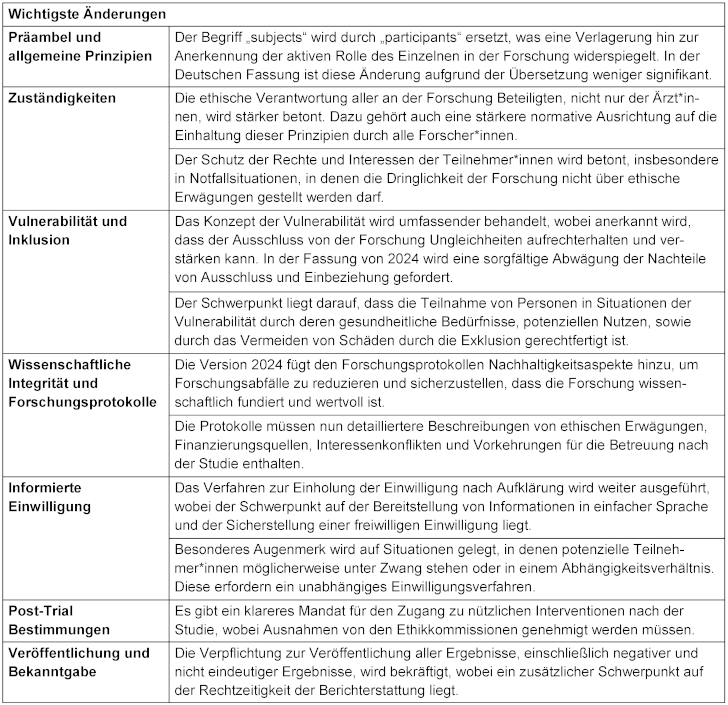
2.3 Interpretation der Änderungen
Im Folgenden erörtern wir unsere Interpretation der Änderungen der DvH 2024 gegenüber 2013, insbesondere mit Blick auf ihre Bedeutung für die Bereiche der medizinischen Informatik, Biometrie und Epidemiologie.
2.3.1 Die neue Rolle der Forscher*innen
Eine der aufmerksamkeitsstärksten Aktualisierungen der DvH 2024 ist die Ausweitung des Geltungsbereichs von Ärzt*innen auf „alle Einzelpersonen, Teams und Organisationen, die an medizinischer Forschung beteiligt sind“ (Art. 2, Übers. d. Verf.) in der Präambel der Deklaration. Die Version von 2013 richtete sich in der Präambel primär an Ärzt*innen und bezog in einzelnen Artikeln (vgl. Art. 9, 12) auch weitere Angehörige der Gesundheitsberufe mit ein. In der gesamten neuen Fassung werden Artikel, die sich nicht mit Aspekten der medizinischen Forschung befassen, die spezifisch für Ärzt*innen oder andere Angehörige der Gesundheitsberufe sind (z.B. Art. 14), entsprechend angepasst [14], [15], [16] (vgl. Art. 2, 6, 9, 10, 12, 18, 20, 22, 31). Sie passt sich damit den „International Ethical Guidelines for Health Research Involving Humans“ des Council for International Organizations of Medical Sciences von 2016 [17], [18] an. Gleichzeitig geht sie aber deutlich über den ursprünglichen Geltungsbereich hinaus, der dadurch gekennzeichnet war, dass der Weltärztebund Regelungen für seine Berufsvertreter*innen – die Ärzt*innen – formulierte, nicht aber für Angehörige anderer Berufe.
Damit stellt die DvH 2024 in der Umsetzung neue Anforderungen an Forscher*innen aus der medizinischen Informatik, der Biometrie und der Epidemiologie:
- Berücksichtigung einer gleichmäßigen Verteilung von Risiken, Lasten und Nutzen auf die verschiedenen Bevölkerungsgruppen (Artikel 6),
- Teilnahme am aktiven Schutz der Teilnehmer*innen (Art. 6 und 9),
- Berücksichtigung ethischer, rechtlicher und regulatorischer Standards (Art. 10),
- Überwachung der ethischen Durchführung von Forschungsarbeiten (Art. 12),
- Bewertung des Managements und der Ausgewogenheit von Risiken, Belastungen und Nutzen (Art. 18),
- Bewertung der Ungleichheiten zwischen Bevölkerungsgruppen, insbesondere in Situationen der Vulnerabilität (Art. 20),
- transparente Informationen über Qualifikationen im Forschungsprotokoll (Art. 22)
- und die Verantwortung für die Einholung der informierten Einwilligung der potenziellen Teilnehmer*innen (Artikel 31).
Die DvH ist nicht rechtsverbindlich, sie hat jedoch in erheblichem Maße Regelungen wie z.B. die Verordnung über klinische Prüfungen der Europäischen Union [19] beeinflusst. Es bleibt abzuwarten, inwieweit die Ausweitung der Rollenverantwortung anderer Forscher*innen sich in Aktualisierungen des jeweiligen Berufsrechts oder der Verhaltenskodizes niederschlägt. Insbesondere in Bezug auf FEKs ist eine verpflichtende Aufsicht für medizinische Forschung im ärztlichen Berufsrecht vorgeschrieben. Da es jedoch kein Berufsrecht gibt, das für alle Forscher*innen gilt, würde eine Verallgemeinerung einer solchen rechtlichen Verpflichtung einen angepassten Rechtsrahmen erfordern. Unabhängig vom jeweiligen Berufsrecht stellt die Einhaltung der Prinzipien der DvH erstmals moralisch die Anforderung der Beratung durch FEKs auch für Studien ohne die Beteiligung von Ärzt*innen.
Was die Terminologie anbelangt, so ist die bemerkenswerteste Aktualisierung in der englischen Fassung der DvH 2024 die Ersetzung des Begriffs „human subjects“ durch „participant“, wodurch die Freiwilligkeit sowie „die Rechte, die Handlungsfähigkeit und die Bedeutung dieser Personen als Partner im Forschungsunternehmen“ (Übers. d. Verf.) [16] betont werden. Die offizielle deutsche Fassung bleibt abzuwarten, allerdings war – wie eingangs erwähnt – bereits in der Übersetzung von 2013 die Rede von „Teilnehmern“ bzw. „Menschen“. Eine konsequentere Nutzung des Terms „Teilnehmer“ könnte auch hier zur Betonung der Freiwilligkeit beitragen.
2.3.2 Stärkung der Ethik-Kommissionen
Die DvH 2024 aktualisiert Art. 23 über FEKs signifikant. Erstens wird in der Fassung von 2024 die Unabhängigkeit der Ethik-Kommissionen weiter betont, indem ausreichende Ressourcen und angemessene Qualifikationen hervorgehoben werden. Zweitens wurde der Schwerpunkt der Ethikausschüsse von „Gesetzen und Vorschriften“ auf „ethische, rechtliche und regulatorische Normen“ erweitert. Drittens verlangt die Version 2024 nun ausdrücklich, dass die Ethikkommissionen aller Länder, die an internationaler Forschung beteiligt sind, das Forschungsprojekt genehmigen müssen. Und schließlich wurden die erforderlichen Rechte der Ethikausschüsse erweitert, um die Genehmigung für laufende Forschungsarbeiten zurückzuziehen und laufende Forschungsarbeiten auszusetzen:
Das Recht, laufende Forschungsarbeiten strenger zu überwachen, kann folglich eine Änderung der Regulatorik für kontinuierliche Forschung ermöglichen. Ein Beispiel ist das Data Use and Access Committee (DUAC, deutsch: (Daten-)zugriffs- und Nutzungskomitee), das Anträge auf Nutzung von Registerdaten prüft. Aktuell muss jede einzelne Datennutzung zusätzlich durch die FEK genehmigt werden. Wenn die FEK jedoch stärker in die Arbeit des DUAC eingebunden ist, könnte es bestimmte Aufgaben an dieses Gremium delegieren. Voraussetzung dafür ist, dass das DUAC festgelegte Qualitätsstandards einhält. In diesem Fall könnten viele Anträge ohne erneute Prüfung durch das FEK bearbeitet werden. Diese Delegation würde sowohl Ethikkommissionen als auch die Forscher*innen entlasten und gleichzeitig sicherstellen, dass die Meldepflichten und Überwachungsmechanismen aufrechterhalten würden. Überwachungs- und Kontrollmechanismen könnten je nach Bedarf oder spontan durch die FEK eingeführt werden, so dass flexibel auf neue Situationen und Stichprobeninterventionen reagiert werden könnte. Der neue Rahmen der DvH bietet die Möglichkeit, bei Bedarf einzugreifen oder die Genehmigung zu entziehen.
2.3.3 Ausdehnung des Geltungsbereichs über Einzelpersonen hinaus
Eine häufig diskutierte Aktualisierung der DvH, die sich durch viele Teile der Deklaration zieht, ist die Ausweitung des Anwendungsbereichs über Individuen hinaus [20], [21].
Die Version 2024 ergänzt die Minimierung von Umweltschäden durch das Streben nach ökologischer Nachhaltigkeit und betont, dass diese bereits bei der Gestaltung berücksichtigt werden muss (Art. 11). Eine wichtige Ergänzung, denn die Minimierung von Umweltschäden reicht nicht aus, um ökologische Nachhaltigkeit zu erreichen. Ferner wird in Art. 21 der aktualisierten Fassung hinzugefügt, dass gerechtfertigte medizinische Forschung erfolgversprechend und abfallmindernd sein muss.
Darüber hinaus wird in der aktualisierten DvH die Betonung auf strukturelle Ungerechtigkeiten verstärkt. Art. 6 betont den Kontext der Ungleichheiten, in dem medizinische Forschung stattfindet, und fügt hinzu, dass die Verteilung von Nutzen, Risiken und Lasten einer ethischen Prüfung bedarf. Außerdem werden Gemeinschaften (Original: „Communities“) als wichtige Akteure in der medizinischen Forschung eingeführt. Teilnehmer*innen und ihre Gemeinschaften müssen in die Planung und Durchführung der Forschung einbezogen werden (Artikel 6). Durch diese Änderungen werden strukturelle Ungerechtigkeiten, die sowohl durch Machtverhältnisse zwischen Forscher*innen und Teilnehmer*innen als auch durch strukturelle Ungleichheiten hervorgerufen werden, adressiert.
Eine weitere bemerkenswerte Änderung ist der erheblich aktualisierte Abschnitt der DvH über Vulnerabilität. Neben einer sensibleren Verwendung der Terminologie der Vulnerabilität, die darauf abzuzielen scheint, Stereotypisierung und Übergeneralisierung zu vermeiden, wird in der aktualisierten Fassung anerkannt, dass der rigorose Ausschluss aufgrund von Situationen der Vulnerabilität das große Risiko der Unterrepräsentation und des fehlenden Wissens über besondere gesundheitliche Bedürfnisse birgt (Artikel 19 und 20). Die aktualisierte Version plädiert nichtmehr nur für den Schutz solcher Gruppen, Individuen oder Gemeinschaften, sondern auch explizit für ihre Inklusion in Forschungsvorhaben. Die möglichen Schäden durch Exklusion müssen nun mit den möglichen Schäden durch Inklusion verglichen werden (Art. 19) und eine Inklusion insbesondere dann angestrebt werden, wenn eine Exklusion zu einer verstärkten Ungleichheit führen würde (Art. 20).
Schließlich wurden die Bedingungen für die Einwilligung nach Aufklärung angepasst, um die Inklusion zu betonen: Potenzielle Teilnehmer*innen müssen in einfacher Sprache über die Ziele, Methoden, den erwarteten Nutzen und die möglichen Risiken und Belastungen informiert werden (Artikel 26). Die Einbeziehung von Teilnehmer*innen in vulnerablen Situationen wurde dahingehend angepasst, dass nun auch Teilnehmer*innen einbezogen werden können, die nicht in der Lage sind, eine Einwilligung nach Aufklärung zu erteilen, sofern „die Forschung wahrscheinlich entweder einen persönlichen Nutzen für sie hat oder nur ein minimales Risiko und eine minimale Belastung mit sich bringt“ (Artikel 28, Übers. d. Verf.).
2.3.4 Künstliche Intelligenz in der Deklaration von Helsinki
Die DvH adressiert in der aktualisierten Fassung von 2024 nicht explizit die ethischen Bedenken im Zusammenhang mit künstlicher Intelligenz (KI) im Gesundheitswesen, bzw. in der Gesundheitsforschung.
Im Zusammenhang mit dem Einsatz von künstlicher Intelligenz im Gesundheitswesen haben Ethiker*innen die Implikationen der disruptiven Technologie breit untersucht und bspw. Erklärbarkeit („Explicability“ oder „Explainability“) als genuines ethisches Prinzip diskutiert [22], [23], [24]. Darüber hinaus befasst sich die Literatur zur Ethik der KI im Gesundheitswesen unter anderem mit Problemen der Verzerrungen (Biases), sowie nicht reproduzierbarer oder nicht verallgemeinerbarer Ergebnisse [25] und Problemen in der Zuweisung von Verantwortung [26]. In einem aktuellen Thesenpapier zu KI im Gesundheitswesen führt beispielsweise die Bundesärztekammer aus, dass die Entwicklung von KI im Gesundheitswesen die Digitalisierung des Gesundheitswesens vorantreibt und riesige Mengen an Trainingsdaten produziert, die mitunter in Konflikt mit dem Schutz der Privatsphäre und dem Datenschutz stehen [27]. Auf der einen Seite argumentieren einige, dass eine korrekte und differenzierte Umsetzung der in der DvH dargelegten Prinzipien die Risiken der Analyse und Entwicklung von KI berücksichtigt [21], [28], [29]. Andererseits beanstanden andere, dass die aktualisierte DvH nicht auf die Notwendigkeit spezifischer Probleme der „Forschung im Bereich der künstlichen Intelligenz oder des maschinellen Lernens“ (Übers. d. Verf.) [14] eingeht. Ribeiro kritisiert insbesondere, dass die aktualisierte DvH keinen Leitfaden zum Umgang mit KI-bezogenen Bedenken in Bezug auf „Datenschutz, algorithmische Verzerrungen und die Rolle des maschinellen Lernens bei der klinischen Entscheidungsfindung“ (Übers. d. Verf.) [30] enthält.
Artikel 6 der DvH 2024 fordert eine faire Verteilung von Risiken, Belastungen und Nutzen, was grundsätzlich auch die Vermeidung von Biases einschließt. Die Aktualisierung der DvH umfasst zudem die Relevanz der Inklusion von Gruppen und Individuen in Situationen der Vulnerabilität, um Benachteiligungen zu vermeiden (Art. 19, 20). Allerdings benennt die Deklaration keine technischen Ursachen oder Korrekturmechanismen für solche Verzerrungen, wie sie in KI-Systemen durch nicht-repräsentative Trainingsdaten oder Modellarchitekturen entstehen können. Für eine praktische Umsetzung sind daher zusätzliche Leitlinien erforderlich, etwa zur Datenrepräsentativität.
Bedenken zur Erklärbarkeit von KI Modellen in der Medizin beziehen sich vor allem auf die Anwendung in der Diagnostik und der Therapieentscheidung [24]. Damit ist auch die Forschung betroffen, welche die Anwendung von KI praktisch untersucht. Die DvH verlangt, dass Teilnehmer*innen ausreichend informiert werden, um freiwillig in eine Studie einzuwilligen (Art. 25–32). Nicht-erklärbare KI könnte eine solche Einwilligung erschweren. Andererseits konkretisiert die Deklaration nicht, was „ausreichend informiert“ im Kontext komplexer KI-Modelle bedeutet. In der Praxis werden solche Modelle häufig akzeptiert. Über die Notwendigkeit und den Grad an Erklärbarkeit gibt es allerdings auch in der in der ethischen Diskussion noch keinen Konsens [24].
In Artikel 9 der DvH wird deklariert, dass die Verantwortung für den Schutz der Teilnehmer*innen immer bei den Forscher*innen liegt. Sie definiert damit ein Vorgehen der Verantwortungszuweisung das im Falle von KI nicht trivial ist und das aktive Annehmen von Verantwortung durch die Forscher*innen als Grundvoraussetzung für die Anwendung von KI in der Forschung setzt. Um eine solche (moralische) Verantwortungszuweisung legitimieren zu können, bedarf es Kontrollmechanismen, welche die Autonomie der Entscheidungsfindung durch KI einschränken (bspw. Human in the Loop [31]).
Auch die Nutzung großer Datenmengen und deren Sekundärverwertung sind ein zentrales Thema der KI-Forschung. Während die Deklaration von Helsinki hier eher allgemein bleibt, bietet die Deklaration von Taipeh [32] eine deutlich differenziertere ethische Grundlage für den Umgang mit Gesundheitsdaten. Für datenintensive KI-Projekte ist sie daher eine wichtige Ergänzung, welche in Art. 32 der DvH referenziert wird.
Der Einsatz von Künstlicher Intelligenz (KI) in der medizinischen Forschung ist somit ethisch nur dann vertretbar, wenn zentrale Prinzipien wie Patientenautonomie, Gerechtigkeit, Fairness sowie erkenntnistheoretische Standards gewahrt bleiben. Diese Anforderungen lassen sich grundsätzlich mit den normativen Vorgaben der Deklaration von Helsinki in Einklang bringen. Nach unserem Verständnis sind bislang keine ethischen Bedenken im Kontext von KI in der medizinischen Forschung bekannt, die nicht zumindest implizit durch die bestehenden Prinzipien der Deklaration adressiert würden. Insbesondere die technologieunabhängige Formulierung der Deklaration erlaubt eine weite Auslegung, die auch neuartige Forschungsansätze wie den Einsatz von KI umfasst. Gleichwohl kann argumentiert werden, dass gerade bei disruptiven Technologien wie KI, zusätzliche ethische Leitlinien erforderlich sind, um spezifische Herausforderungen – etwa fehlende Erklärbarkeit, verteilte Verantwortung oder datenethische Fragestellungen – zu adressieren.
3 Diskussion
Während viele lokale Leitlinien für Humanforscher*innen, die kein medizinische Fachpersonal sind, bereits auf die DvH verweisen, werden sie in der aktualisierten Fassung nun ausdrücklich angesprochen. Vor diesem Hintergrund wird die Rolle der Forscher*innen in der Fassung von 2024 weiter differenziert. Gleichzeitig wird die Zielgruppe der DvH durch die ausdrückliche Einbeziehung aller Forscher*innen deutlich erweitert. Die Ausweitung des Geltungsbereichs der DvH führt natürlich nicht zu einer rechtlichen Verbindlichkeit, kann aber den Weg zu einem Rechtsrahmen ebnen, der sich nicht auf das Berufsrecht beschränkt, sondern die Rechtsgrundlage für die Forschung an menschlichen Teilnehmer*innen bildet. So könnte beispielsweise die Aufsicht durch die FEKs für alle Forscher*innen, die an der Forschung am Menschen beteiligt sind, obligatorisch sein. Ein Beispiel für eine solche Rechtsgrundlage findet sich im Humanforschungsgesetz der Schweiz [33].
Die DvH in ihrer aktuellen Fassung hat den Geltungsbereich auch über Einzelpersonen, d.h. Teilnehmer*innen, hinaus erweitert und fordert ausdrücklich ethische Prinzipien, um Ungleichheiten und den Klimawandel zu berücksichtigen. Ferner fällt auf, dass die Übernahme konzeptioneller Diskurse in die Aktualisierungen Eingang gefunden hat (z.B. für „Vulnerabilität“ und „Autonomie“ siehe Appendix A in Anhang 1 [Anh. 1], Art. 9, 19, 20).
Die ethischen Herausforderungen, die sich aus dem Einsatz von KI in der medizinischen Forschung ergeben, lassen sich weitgehend durch die Prinzipien der Deklaration von Helsinki adressieren, sofern diese technologieunabhängig interpretiert werden. Gleichwohl sollte angesichts der spezifischen Merkmale disruptiver Technologien wie KI in Betracht gezogen werden, ergänzende ethische Leitlinien zu entwickeln, die bestehende Normen präzisieren und anwendungsbezogen konkretisieren.
Im Zusammenhang mit medizinischen Daten können wir jedoch nach wie vor einen Mangel an Leitlinien für Studien in geclusterten Settings kritisieren: Immer mehr Studien werden unter Bedingungen durchgeführt, die nur geclustert umgesetzt werden können, was eine individuelle Patienteneinwilligung zu einer Herausforderung macht [34]. Darüber hinaus greift die Informationstechnologie in die Prozesse der Gesundheitsversorgung ein, so dass es manchmal unmöglich ist, einzelne Patienten auszuschließen. Infolgedessen ist die informierte Einwilligung gefährdet, was die dringende Notwendigkeit der Entwicklung entsprechender Strategien verdeutlicht. Auch wenn dies nicht unbedingt die Aufgabe der DvH ist, zumal der WMA nicht die Bereiche medizinische Informatik, Biometrie und Epidemiologie vertritt, bleiben Fragen unbeantwortet, was den Bedarf an weiteren Diskussionen unterstreicht.
Ungeachtet der aktuellen Aktualisierung muss die Standardisierung der Forschung am Menschen als ein zeit- und kontextabhängiger Prozess betrachtet werden, der eine ständige Bewertung und Weiterentwicklung sowie eine fortlaufende diskursive Debatte erfordert. Die eigentliche Herausforderung liegt in der Anwendung bestehender Standards auf konkrete Fälle [9].
Abschließend konzentriert sich dieser Artikel nur auf ausgewählte Aktualisierungen und Kernpunkte der DvH, die für die Bereiche medizinische Informatik, Biometrie und Epidemiologie relevant sind, und bietet nur partielle Einsicht in die Deklaration.
Anmerkungen
Danksagungen
Wir danken der WMA für die Genehmigung zur Veröffentlichung der vollständigen Synopse.
ORCIDs der Autor*innen
- Nils Freyer: 0000-0002-4460-3650
- Myriam Lipprandt: 0000-0001-9371-0551
- Andreas Goldschmidt: 0009-0004-5073-6806
- Dominik Groß: 0000-0001-9979-8531
- Rainer Röhrig: 0000-0002-0032-5118
Beiträge der Autor*innen
NF, RR: Idee, Entwurf, Konzeption der Arbeit. NF, RR führten die formale Analyse durch. Alle Autoren interpretierten die Ergebnisse. NF verfasste den Manuskriptentwurf. Alle Autor*innen überprüften und überarbeiteten das Manuskript.
Interessenkonflikte
Die Autor*innen erklären, dass sie keine Interessenkonflikte in Zusammenhang mit diesem Artikel haben.
KI-Unterstützung
DeepL wurde zur Unterstützung der deutschen Übersetzung dieses Manuskripts verwendet. Es wurden keine Texte generiert.
Literatur
[1] Goldschmidt A, Deserno TM, Winter A, Gerecke BJ. 22 Elemente eines Ethikkodex für Medizin- und Informationstechnische Fachgesellschaften. In: Ethische Perspektiven auf Biomedizinische Technologie. De Gruyter; 2020. p. 233-245. DOI: 10.1515/9783110645767-022[2] Bošnjak S. The declaration of Helsinki: The cornerstone of research ethics. Arch Oncol. 2001;9(3):179-184.
[3] The Nuremberg Code (1947). BMJ. 1996 Dec 7;313(7070):1448. DOI: 10.1136/bmj.313.7070.1448
[4] Annas GJ, Grodin MA, editors. The Nazi Doctors and the Nuremberg Code: Human Rights in Human Experimentation. Oxford University Press; 1992. DOI: 10.1093/oso/9780195070422.001.0001
[5] Weindling P. The origins of informed consent: the International Scientific Commission on Medical War Crimes, and the Nuremburg code. Bull Hist Med. 2001;75(1):37-71. DOI: 10.1353/bhm.2001.0049
[6] Groß D. Nürnberger Kodex. In: Lenk C, Duttge G, Fangerau H, editors. Handbuch Ethik und Recht der Forschung am Menschen. Berlin, Heidelberg: Springer; 2014. p. 559-563. DOI: 10.1007/978-3-642-35099-3_88
[7] Roelcke V, Maio G, editors. Twentieth century ethics of human subjects research: historical perspectives on values, practices, and regulations. Franz Steiner Verlag; 2004.
[8] Deutsche Sektion der Internationalen Ärzt*innen für die Verhütung des Atomkrieges/Ärzt*innen in sozialer Verantwortung e.V. (IPPNW). Nürnberger Kodex (1997). Dokumente und Erklärungen. [cited 2025 Apr 22]. Available from: https://www.ippnw.de/der-verein/geschichte-der-ippnw/erklaerungen/artikel/de/nuernberger-kodex-1997.html
[9] Groß D. Forschung am Menschen. In: Neuhäuser C, Raters ML, Stoecker R, editors. Handbuch Angewandte Ethik. Stuttgart: J.B. Metzler; 2023. p. 719-726. DOI: 10.1007/978-3-476-05869-0_97
[10] Council of Europe. Convention for the protection of Human Rights and Dignity of the Human Being with regard to the Application of Biology and Medicine: Convention on Human Rights and Biomedicine (ETS No. 164). Treaty Office; 1999 [cited 2025 Apr 22]. Available from: https://www.coe.int/en/web/conventions/full-list
[11] WMA – The World Medical Association. Declaration of Helsinki 1964. 1964 [cited 2025 Feb 13]. Available from: https://www.wma.net/what-we-do/medical-ethics/declaration-of-helsinki/doh-jun1964/
[12] WMA – The World Medical Association. WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Participants. 2024 [cited 2024 Dec 17]. Available from: https://www.wma.net/policies-post/wma-declaration-of-helsinki/
[13] Deutsche Gesellschaft für Medizinische Informatik, Biometrie und Epidemiologie (GMDS). Ethische Leitlinien. GMDS; 2008.
[14] Bierer BE. Declaration of Helsinki-Revisions for the 21st Century. JAMA. 2025 Jan;333(1):18-19. DOI: 10.1001/jama.2024.22281
[15] Zhang H, Wu Y, Wang H, Zhao W, Cong Y. Sixty years of ethical evolution: The 2024 revision of the Declaration of Helsinki (DoH). Health Care Sci. 2024 Dec;3(6):371-373. DOI: 10.1002/hcs2.126
[16] Resneck JS Jr. Revisions to the Declaration of Helsinki on Its 60th Anniversary: A Modernized Set of Ethical Principles to Promote and Ensure Respect for Participants in a Rapidly Innovating Medical Research Ecosystem. JAMA. 2025 Jan;333(1):15-17. DOI: 10.1001/jama.2024.21902
[17] Rägo L, Sawyer J. Keeping ethical pace with medical research: the 10th revision of the Declaration of Helsinki. BMJ. 2025 Jan;388:r9. DOI: 10.1136/bmj.r9
[18] The Council for International Organizations of Medical Sciences (CIOMS). 2016 International ethical guidelines for health-related research involving humans. Geneva: CIOMS; 2016. DOI: 10.56759/rgxl7405
[19] Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC. Text with EEA relevance. OJ L Apr 16, 2014. Available from: http://data.europa.eu/eli/reg/2014/536/oj/eng
[20] Reis AA, Upshur R, Moodley K. Future-Proofing Research Ethics-Key Revisions of the Declaration of Helsinki 2024. JAMA. 2025 Jan;333(1):20-21. DOI: 10.1001/jama.2024.22254
[21] Bibbins-Domingo K, Brubaker L, Curfman G. The 2024 Revision to the Declaration of Helsinki: Modern Ethics for Medical Research. JAMA. 2025 Jan;333(1):30-31. DOI: 10.1001/jama.2024.22530
[22] Adams J. Defending explicability as a principle for the ethics of artificial intelligence in medicine. Med Health Care Philos. 2023 Dec;26(4):615-623. DOI: 10.1007/s11019-023-10175-7
[23] Ursin F, Timmermann C, Steger F. Explicability of artificial intelligence in radiology: Is a fifth bioethical principle conceptually necessary? Bioethics. 2022 Feb;36(2):143-153. DOI: 10.1111/bioe.12918
[24] Freyer N, Groß D, Lipprandt M. The ethical requirement of explainability for AI-DSS in healthcare: a systematic review of reasons. BMC Med Ethics. 2024 Oct;25(1):104. DOI: 10.1186/s12910-024-01103-2
[25] Morley J, Machado CCV, Burr C, Cowls J, Joshi I, Taddeo M, Floridi L. The ethics of AI in health care: A mapping review. Soc Sci Med. 2020 Sep;260:113172. DOI: 10.1016/j.socscimed.2020.113172
[26] Kempt H, Nagel SK. Responsibility, second opinions and peer-disagreement: ethical and epistemological challenges of using AI in clinical diagnostic contexts. J Med Ethics. 2022 Apr;48(4):222-229. DOI: 10.1136/medethics-2021-107440
[27] Bundesärztekammer, editor. Thesenpapier der Bundesärztekammer – Künstliche Intelligenz in der Gesundheitsversorgung. Deutscher Ärzteverlag; 2025. Available from: https://www.bundesaerztekammer.de/fileadmin/user_upload/BAEK/Themen/Digitalisierung/Thesenpapier_KI_in_der_Gesundheitsversorgung_03.2025.pdf
[28] Abbasi K. Declaration of Helsinki: a new revision at sixty years. J R Soc Med. 2024 Aug;117(8):255. DOI: 10.1177/01410768241284497
[29] Shaw JA. The Revised Declaration of Helsinki-Considerations for the Future of Artificial Intelligence in Health and Medical Research. JAMA. 2025 Jan;333(1):26-27. DOI: 10.1001/jama.2024.22074
[30] Ribeiro Junior HL. AI ethics in medical research: the 2024 Declaration of Helsinki. Lancet. 2024 Nov;404(10467):2048-2049. DOI: 10.1016/S0140-6736(24)02376-6
[31] Crootof R, Kaminski ME, Price II WN. Humans in the Loop. 76 Vanderbilt Law Review 429 (2023), U of Colorado Law Legal Studies Research Paper No. 22-10, U of Michigan Public Law Research Paper No. 22-011. SSRN; 2022. DOI: 10.2139/ssrn.4066781
[32] WMA – The World Medical Association. WMA Declaration of Taipei on Ethical Considerations regarding Health Databases and Biobanks. 2016 [cited 2025 Mar 4]. Available from: https://www.wma.net/policies-post/wma-declaration-of-taipei-on-ethical-considerations-regarding-health-databases-and-biobanks/
[33] Federal Office of Public Health (FOPH). Regulation of human research in Switzerland. 2024 [cited 2025 Mar 4]. Available from: https://www.bag.admin.ch/bag/en/home/medizin-und-forschung/forschung-am-menschen/regelung-humanforschungsgesetz.html
[34] Nix HP, Weijer C, Brehaut JC, Forster D, Goldstein CE, Taljaard M. Informed consent in cluster randomised trials: a guide for the perplexed. BMJ Open. 2021 Sep;11(9):e054213. DOI: 10.1136/bmjopen-2021-054213
Anhänge
| Anhang 1 | Appendizes (mibe000301_Anhang1.pdf, application/pdf, 229.17 KBytes) |




